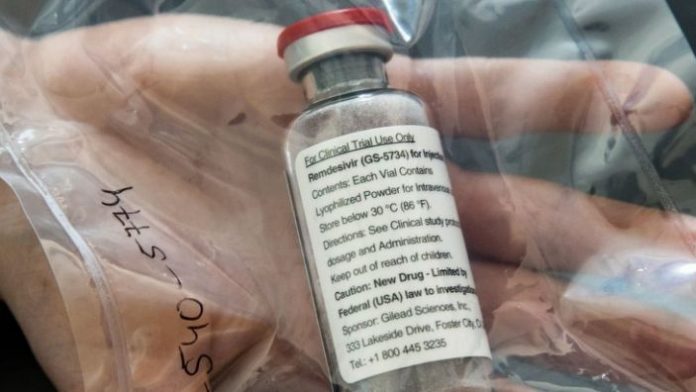
La Administración de Medicamentos y Alimentos de Estados Unidos (FDA) autorizó el uso de emergencia del antiviral Remdesivir en la lucha contra el coronavirus.
Eso significa que los hospitales estadounidenses ahora podrán utilizar al fármaco, originalmente desarrollado para combatir el Ébola, en el tratamiento de los casos más graves de Covid-19.
La autorización se dio después de que un reciente ensayo clínico encontrara que el medicamento había ayudado a acortar el tiempo de recuperación de personas gravemente enfermas por el coronavirus.
Sin embargo, el uso de Remdesivir no mejoró significativamente las tasas de supervivencia.
Y los expertos también han advertido que el medicamento -que es producido por la compañía farmacéutica Gilead, con sede en California- no debe verse como una «bala mágica» en la lucha contra el coronavirus.
Durante una reunión con el presidente estadounidense Donald Trump en la Casa Blanca, el presidente ejecutivo de Gilead, Daniel O’Day, dijo que la autorización de la FDA era un primer paso importante.
O’Day también anunció que la compañía va a donar 1,5 millones de dosis del medicamento.
«Es la primera terapia autorizada para Covid-19, por lo que estamos muy orgullosos de ser parte de ella», dijo por su parte el comisionado de la FDA, Stephen Hahn.
La autorización de emergencia de la FDA no es lo mismo que la aprobación formal, que requiere un mayor nivel de revisión.
¿Qué sabemos sobre Remdesivir?
El Remdesivir no funcionó como cura para el Ébola, y Gilead lo describe en su sitio web como «un medicamento experimental que no ha establecido la seguridad o la eficacia para el tratamiento de ninguna afección».
La farmacéutica también advierte ahí sobre posibles efectos secundarios graves.
Sin embargo, el presidente Trump ha sido un defensor vocal del Redemsivir como tratamiento potencial para el coronavirus.
En su ensayo clínico, el Instituto Nacional de Alergias y Enfermedades Infecciosas de EE.UU. (NIAID) encontró que el antiviral redujo la duración de los síntomas de 15 a 11 días.
Los ensayos involucraron a 1.063 personas en hospitales de todo el mundo, incluidos Estados Unidos, Francia, Italia, Reino Unido, China y Corea del Sur. Algunos pacientes recibieron el medicamento y otros recibieron un placebo.
El Dr. Anthony Fauci, que dirige el NIAID, dijo después que el Remdesivir tenía «un efecto claro, significativo y positivo al disminuir el tiempo de recuperación«.
Sin embargo, aunque el medicamento puede ayudar a la recuperación, y posiblemente evitar que las personas tengan que ser tratadas en cuidados intensivos, los ensayos no dieron ninguna indicación clara de si puede prevenir las muertes por coronavirus.
Y la valoración del NIAID sobre el Remdesivir se produjo poco después de que Gilead hiciera públicos los resultados preliminares de un estudio respaldado por el NIAID, y días después de que el fármaco no superara otro ensayo clínico llevado a cabo en China y del que se hizo eco la revista especializada en medicina The Lancet.

En el ensayo realizado en Wuhan, la ciudad china donde se detectó el primer caso de covid-19, el uso de este medicamento en pacientes con la enfermedad no ofreció resultados favorables, en comparación con otro grupo de adultos que se usó como control, excepto en el caso de aquellos que requerían el uso de ventiladores.
La prueba en China, sin embargo, solamente incluyó a 237 pacientes y fue detenida antes de tiempo debido a que no fue posible conseguir suficientes voluntarios.
Ante esos resultados, la farmacéutica Gilead aseguró que el ensayo no era estadísticamente relevante.
El Dr. Fauci, por su parte, señaló que el llevado a cabo en China no era un «estudio adecuado».